Scoperta la chiave che apre la “porta del ferro” delle cellule
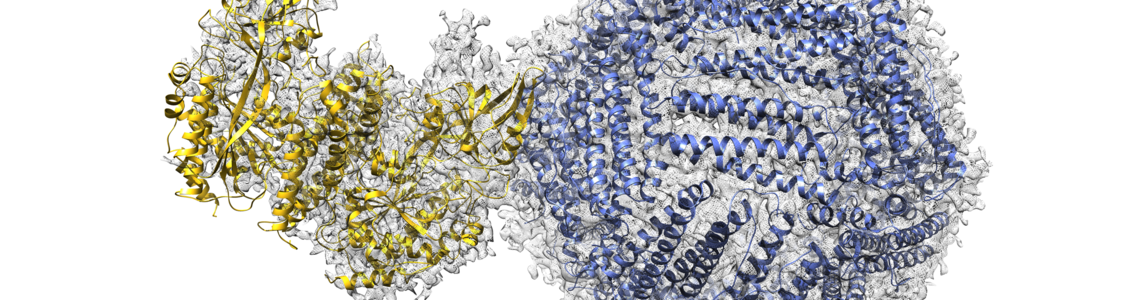
Il team di ricerca guidato da Beatrice Vallone e Alberto Boffi del Dipartimento di Scienze biochimiche A. Rossi Fanelli in collaborazione con il laboratorio IIT @Sapienza, ha osservato per la prima volta la struttura del complesso formato dalla proteina ferritina e il suo recettore cellulare (CD17). L’analisi della struttura del complesso ferritina-recettore ha rivelato un importante meccanismo biologico fino a oggi sconosciuto, ovvero il processo con cui il ferro entra nelle cellule. I risultati dello studio, pubblicati sulla rivista Nature Communications, non solo ampliano lo scenario delle conoscenze scientifiche di base, ma hanno anche ricadute pratiche di rilievo.
I ricercatori hanno visto che il plasmodio della malaria e i virus della famiglia degli arenavirus e parvovirus utilizzano la zona del recettore che apre le porte al ferro, per introdursi nelle cellule, infettandole. Conoscere la strada attraverso cui il virus o il plasmodio entrano nella cellula permette di mettere a punto una strategia per ingannarli: si può immaginare di costruire piccole molecole che impediscano al virus di trovare libera la porzione di recettore per legarsi alle cellule.
Per ottenere tali risultati, è stata utilizzata l’innovativa crio-microscopia elettronica, una tecnica che permette di ricostruire la struttura tridimensionale delle molecole con dettaglio atomico, che è valsa a Jacques Dubochet, Joachim Frank e Richard Henderson il premio Nobel per la chimica 2017. I microscopi elettronici di ultima generazione sono disponibili presso la Columbia University, l’Advanced Science Research Center della City University of New York e la European Synchrotron Research Facility, dove Linda Celeste Montemiglio e Claudia Testi, giovani ricercatrici della Sapienza e prime autrici del lavoro, hanno trascorso un periodo di ricerca collaborativa.
Lo studio ha un’altra importante implicazione in campo medico, permetterà infatti di disegnare nuovi nanovettori per la diagnosi e la cura del cancro. Già da diversi anni il team della Sapienza, in collaborazione con l’Istituto di Biologia e patologia molecolari del Cnr, sfrutta il complesso ferritina-recettore come “chiave molecolare” per veicolare selettivamente farmaci antitumorali.
“Adesso che conosciamo a fondo la struttura del complesso – spiega Beatrice Vallone, coordinatrice del progetto – sarà possibile sviluppare terapie più specifiche, selettive ed efficaci”.
Riferimenti:
Cryo-EM structure of the human Ferritin-Transferrin Receptor 1 complex - Montemiglio, L.C., Testi, C., Ceci, P., Falvo, E., Pitea, M., Savino, C., Arcovito, A., Peruzzi, G., Baiocco, P., Mancia, F., Boffi, A., des Georges, A., Vallone, B. - Nature Communications 2019. DOI: 10.1038/s41467-019-09098-w
Info
Beatrice Vallone
Dipartimento di Scienze biochimiche A. Rossi Fanelli, Sapienza Università di Roma
beatrice.vallone@uniroma1.it
Alberto Boffi
Dipartimento di Scienze biochimiche A. Rossi Fanelli, Sapienza Università di Roma
alberto.boffi@uniroma1.it



